- + Merck Millipore
- + Thermo Fisher
- + IKA
- + 顯微鏡
- + 光度計
- + 成像系統
- + MACS Miltenyi
- + 均質機
- + 粒子計數器
- + 凍干機
- + 滅菌系統
- + 細胞
- + 微量移液工作站
- + 振蕩培養箱
- + 生物反應器
- + 切片機
- + 培養箱
- + 蠕動泵
- + 細胞破(粉)碎機
- + 轉印膜
- + 超濾管
- + Pellicon 超濾系統
- + 超低溫冰箱
- + 清洗機
- + 干燥機
- + 洗瓶機
- + 離心泵
- + 容積泵
- + 各種閥
- + 酶標儀
- + 洗衣板
- + 旋光儀
- + 折光儀
- + 行星球磨機
- + 振動篩
- + 基因導入儀
- + 手套系列
- + 接頭\\連接器
- + 培養板/培養瓶
- + 溫度控制系統
- + 制冷器
- + 存取系統
- + 軋蓋機
- + 細胞因子
- + 細胞分選儀
- + 生物安全柜
- + 滲透壓儀
- + 拉曼光譜儀
- + 電泳系統
- + 純水系統
- + 萃取儀
- + 譜新生物
- + TA 儀器
- + wako
六步做好倉庫環境監控
更新時間:2020-06-08 瀏覽次數:2419
制藥行業作為關乎國民健康的重要行業,一直以來都受到國家的嚴格監管。從藥品生產到運輸儲存,國家均有相應的法規條例予以規范。
隨著技術的更新、藥品生產化以及溫度敏感性生物藥品產量的增加,各國對藥品質量的把控愈發嚴格,其中藥品(原料藥/成品藥)的儲存環節備受關注。美國、加拿大、歐盟、日本、澳大利亞及中國的藥品生產質量管理規范(GMP)監管機構已要求對存放環境敏感性生命科學產品的倉庫的溫度與相對濕度狀況進行“分布研究”。為幫助各位完成倉庫或其他受監管貯藏空間的分布研究,在此推薦六個關鍵性步驟。
01
創建驗證計劃
驗證主計劃應包括:
• 確定驗證目標。
• 確定質量、計量、及其他工作組在這一過程中的角色與責任。
• 確定包含工藝、設備及空間在內的驗證活動。
• 制定文檔及規程,其中包括假定溫度或濕度發生偏差時公司如何響應。
• 明確驗證時間表。
• 確立管理審批流程,尤其是針對諸如溫度偏差超限之類的不良事件。
• 確認變更控制的方案,以明確在出現諸如設備維護、新基建、貨架重新布置時需要重新驗證。
02
鑒別風險區域
部分區域會因為時間或人員的流動產生較大的溫差等,需要重點關注。比如一些靠近熱源或冷源的位置或者是頻繁搬運產品或設備的區域。
03
制定方案
在確認風險區域之后,將制定用于分布試驗的方案。包括以下幾點:
• 待生成數據的類型——例如溫度、相對濕度、以及測量時間間隔。
• 所用傳感器的數量及位置分布。
• 可接受的溫度或相對濕度漂移量。
04
選擇適當的技術
傳感器應當是現代電子數據記錄儀*的一部分。數據記錄儀在驗證試驗的全過程對數據進行測量、存儲和記錄。隨同數據記錄儀使用的軟件用以配置設備、下載數據。軟件應當能夠生成滿足美國聯邦規程法規(CFR)第11部分、歐盟委員會附件11以及其他包含在歐盟GMP第4章之內的所有要求的表格和圖形報告。
在選擇數據記錄儀時,應查看以下特性:
• 誤差來源min值——即測量不確定性低。
• 小幅溫度變化敏感性。響應速度越快,數據點與測量時間越貼近。
• 長期穩定性,尤其是相對濕度傳感器。其比溫度傳感器更易于發生漂移,質量較差的設備可能在每次使用前后均須進行校準。穩定性好、質量優的數據記錄儀可在12個月或更長校準時間間隔內保持精度。這樣既節約了時間,又因為消除了每次使用前后校準的需求而獲得更好的測量結果。
• 在使用范圍內的高精度。例如,維薩拉記錄儀在工作范圍-90至85°C內精度可達0.10°C,相對濕度精度可達百分之一。
•在量程內的校準的可溯源性。
•清晰、豐富、且可調閱查看的校準記錄。

維薩拉DL2000系列溫濕度記錄儀
05
配置設備
在您確定了可能的風險區域并確定傳感器分布之后,就可以開始配置設備,進行一系列的驗證工作了。維薩拉可提供一個選裝的GXP文件包,包括URS、FS、TM和RA,維薩拉提供的一個111頁的IQOQ驗證文檔,包含了對軟件和硬件的各項驗證。


06進行試驗和審核數據
您需要確定將要用于評估試驗的報告信息。當試驗完成時,軟件將讀取來自于數據記錄儀的安全文件、顯示所記錄的數據、完成計算過程、并將選定用作分布試驗報告的結論以圖形方式輸出。
試驗文檔通常顯示如下信息:
• 標記有時間和日期的原始數據。
• 諸如min、max和平均溫度之類的計算值。
• 試驗期間所有傳感器的圖表。
• 儀器配置信息。
• 校準信息。
• 試驗的日期與時間。
• 為審核與批準簽字預留的空間。
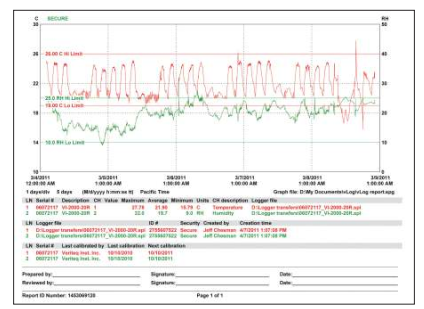
維薩拉分布試驗報告可以顯示上限和下限值,便于快速查看可接受的標準
*藥企中有7家選擇維薩拉的溫濕度監控系統,2018年維薩拉在國內的23家客戶,均順利通過FDA及GMP審查。在日趨嚴苛的監管環境下,維薩拉愿為您護航,與您一同前行。
- (上一篇):細胞程序降溫曲線優化技巧
- (下一篇):生物工藝一次性產品,必須擁有!